โรคความเสื่อมทางสมองเป็นภาวะเสื่อมถอยของเซลล์ประสาทที่รักษาไม่หาย โดยความเสื่อมและ/หรือการตายของเซลล์ประสาทจะค่อย ๆ ดำเนินไปอย่างช้า ๆ โดยอาจใช้เวลานาน 10-20 ปีก่อนที่อาการของความผิดปกติ เช่น ความบกพร่องด้านความจำและการเรียนรู้ในกรณีของโรคสมองเสื่อมอัลไซเมอร์หรือปัญหาการควบคุมกล้ามเนื้อ การเคลื่อนไหวและการทรงตัวในกรณีของโรคพาร์กินสันจะปรากฎชัดเจนจนสังเกตได้
ในบรรดาโรคความเสื่อมทางสมองที่มีอัตราเสี่ยงสูงขึ้นตามอายุและก่อให้เกิดความทุพพลภาพอย่างรุนแรงทั้งทางร่างกาย สภาวะจิตใจและความนึกคิด รวมทั้งส่งผลกระทบอย่างมากต่อครอบครัว คนรอบข้าง และสังคมคือโรคอัลไซเมอร์และพาร์กินสัน เนื่องจากโรคความเสื่อมทางสมองทั้งสองโรคนี้มีระยะเวลาพัฒนาการของโรคที่ยาวนานและปัจจุบันยังไม่มีหนทางรักษาให้หายขาดได้ จะเป็นการดีอย่างยิ่งหากวงการแพทย์ค้นพบวิธีที่สามารถวินิจฉัยความเสี่ยงของโรคได้แต่เนิ่น ๆตลอดจนค้นพบมาตราการชะลอความเสื่อมของเซลล์สมองให้ผู้ที่ยังอยู่ในวัยกลางคนหรือผู้สูงอายุได้ ซึ่งอย่างน้อยก็จะเป็นการเพิ่มคุณภาพชีวิตและลดภาระให้กับคนในสังคมได้ไม่มากก็น้อย
สมองเป็นอวัยวะที่มีความเสี่ยงสูงต่อการเกิดความเสียหายและถูกทำลายได้ง่ายโดยอนุมูลอิสระ ทั้งนี้เนื่องจากสมองเป็นอวัยวะที่มีอัตราการใช้อ็อกซิเจนในกระบวนการสันดาปสูงมากหรือเท่ากับ 20% ของความต้องการอ็อกซิเจนทั้งหมดทั้งๆที่เป็นอวัยวะที่มีน้ำหนักเพียง 2% ของร่างกาย อ็อกซิเจนที่ถูกใช้ในอัตราสูงย่อมก่อให้เกิดอนุมูลอิสระจำนวนมากตามมา ยิ่งไปกว่านั้นเนื้อสมองของคนเรายังอุดมไปด้วยองค์ประกอบกรดไขมันประเภทไม่อิ่มตัวเชิงซ้อน (polyunsaturated fatty acid) ซึ่งเป็นเป้าหมายแรกๆของการถูกทำลายโดยอนุมูลอิสระ แต่ถึงกระนั้นกลับพบว่าสมองมีปริมาณของสารต้านอนุมูลอิสระโดยเฉพาะกลูทาไธโอน (glutathione) ต่ำกว่าอวัยวะสำคัญอื่น ๆ ดังนั้นหากระบบต่อต้านอนุมูลอิสระของสมองเกิดความบกพร่องขึ้นจนไม่สามารถกำจัดอนุมูลอิสระที่เกิดขึ้นเป็นจำนวนมากได้อย่างเพียงพอ เซลล์ประสาทจะตกอยู่ในสภาวะอันตรายและถูกอนุมูลอิสระโจมตีทำลายได้อย่างต่อเนื่อง
กลูทาไธโอนเป็นสารต้านอนุมูลอิสระที่สำคัญที่สุดของร่างกายและสมอง การทำงานกำจัดอนุมูลอิสระของกลูทาไธโอนช่วยควบคุมสมดุลการเกิดและการขจัดอนุมูลอิสระภายในเซลล์ให้อยู่ในระดับที่เหมาะสมเพื่อปกป้องเซลล์จากความเป็นพิษของอนุมูลอิสระและช่วยให้เซลล์ประสาททำงานต่าง ๆ ได้อย่างมีประสิทธิภาพ(1) หลายการศึกษาแสดงให้เห็นว่าภาวะบกพร่องของกลูทาไธโอนนำไปสู่การส่งสัญญาณให้เกิดการสลายตัว(apoptosis)และการตายของเซลล์ประสาทได้(2)
โรคอัลไซเมอร์
ในบรรดาโรคความเสื่อมทางสมองที่มีอัตราเสี่ยงสูงขึ้นตามอายุและก่อให้เกิดความทุพพลภาพอย่างรุนแรงทั้งทางร่างกาย สภาวะจิตใจและความนึกคิด รวมทั้งส่งผลกระทบอย่างมากต่อครอบครัว คนรอบข้าง และสังคมคือโรคอัลไซเมอร์และพาร์กินสัน เนื่องจากโรคความเสื่อมทางสมองทั้งสองโรคนี้มีระยะเวลาพัฒนาการของโรคที่ยาวนานและปัจจุบันยังไม่มีหนทางรักษาให้หายขาดได้ จะเป็นการดีอย่างยิ่งหากวงการแพทย์ค้นพบวิธีที่สามารถวินิจฉัยความเสี่ยงของโรคได้แต่เนิ่น ๆตลอดจนค้นพบมาตราการชะลอความเสื่อมของเซลล์สมองให้ผู้ที่ยังอยู่ในวัยกลางคนหรือผู้สูงอายุได้ ซึ่งอย่างน้อยก็จะเป็นการเพิ่มคุณภาพชีวิตและลดภาระให้กับคนในสังคมได้ไม่มากก็น้อย
สมองเป็นอวัยวะที่มีความเสี่ยงสูงต่อการเกิดความเสียหายและถูกทำลายได้ง่ายโดยอนุมูลอิสระ ทั้งนี้เนื่องจากสมองเป็นอวัยวะที่มีอัตราการใช้อ็อกซิเจนในกระบวนการสันดาปสูงมากหรือเท่ากับ 20% ของความต้องการอ็อกซิเจนทั้งหมดทั้งๆที่เป็นอวัยวะที่มีน้ำหนักเพียง 2% ของร่างกาย อ็อกซิเจนที่ถูกใช้ในอัตราสูงย่อมก่อให้เกิดอนุมูลอิสระจำนวนมากตามมา ยิ่งไปกว่านั้นเนื้อสมองของคนเรายังอุดมไปด้วยองค์ประกอบกรดไขมันประเภทไม่อิ่มตัวเชิงซ้อน (polyunsaturated fatty acid) ซึ่งเป็นเป้าหมายแรกๆของการถูกทำลายโดยอนุมูลอิสระ แต่ถึงกระนั้นกลับพบว่าสมองมีปริมาณของสารต้านอนุมูลอิสระโดยเฉพาะกลูทาไธโอน (glutathione) ต่ำกว่าอวัยวะสำคัญอื่น ๆ ดังนั้นหากระบบต่อต้านอนุมูลอิสระของสมองเกิดความบกพร่องขึ้นจนไม่สามารถกำจัดอนุมูลอิสระที่เกิดขึ้นเป็นจำนวนมากได้อย่างเพียงพอ เซลล์ประสาทจะตกอยู่ในสภาวะอันตรายและถูกอนุมูลอิสระโจมตีทำลายได้อย่างต่อเนื่อง
กลูทาไธโอนเป็นสารต้านอนุมูลอิสระที่สำคัญที่สุดของร่างกายและสมอง การทำงานกำจัดอนุมูลอิสระของกลูทาไธโอนช่วยควบคุมสมดุลการเกิดและการขจัดอนุมูลอิสระภายในเซลล์ให้อยู่ในระดับที่เหมาะสมเพื่อปกป้องเซลล์จากความเป็นพิษของอนุมูลอิสระและช่วยให้เซลล์ประสาททำงานต่าง ๆ ได้อย่างมีประสิทธิภาพ(1) หลายการศึกษาแสดงให้เห็นว่าภาวะบกพร่องของกลูทาไธโอนนำไปสู่การส่งสัญญาณให้เกิดการสลายตัว(apoptosis)และการตายของเซลล์ประสาทได้(2)
โรคอัลไซเมอร์
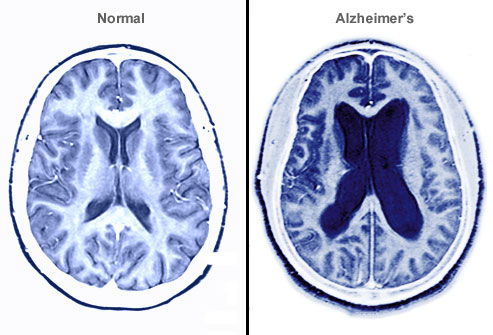
โรคอัลไซเมอร์คือสาเหตุส่วนใหญ่หรือ 60-70% ของการเกิดภาวะสมองเสื่อม (dementia) อาการแรกๆของโรคอัลไซเมอร์มักเริ่มปรากฎในช่วงอายุ 65 ปีขึ้นไปโดยเป็นโรคที่พบได้ใน 6% ของคนกลุ่มนี้ แต่ในกลุ่มคนอายุ 85 ปีขึ้นไปความชุกของโรคจะเพิ่มขึ้นเป็น 50% หลายคนมักเข้าใจผิดว่าโรคอัลไซเมอร์จะต้องเกิดขึ้นกับคนวัยชราทุกคนแต่แท้จริงแล้วโรคอัลไซเมอร์ไม่จัดเป็นกระบวนการเสื่อมอายุตามปกติ เพราะมีผู้สูงอายุเกินร้อยปีจำนวนมากที่ไม่ป่วยเป็นโรคสมองเสื่อมอัลไซเมอร์ จริงอยู่ที่ความจำของคนเราย่อมถดถอยลงไปบ้างตามอายุที่สูงขึ้น แต่ความจำที่บกพร่องลงในอัตราปกติจะไม่รุนแรงถึงขั้นสูญเสียความสามารถในการใช้ความคิดอ่านและทักษะการทำกิจวัตประจำวันขั้นพื้นฐานได้
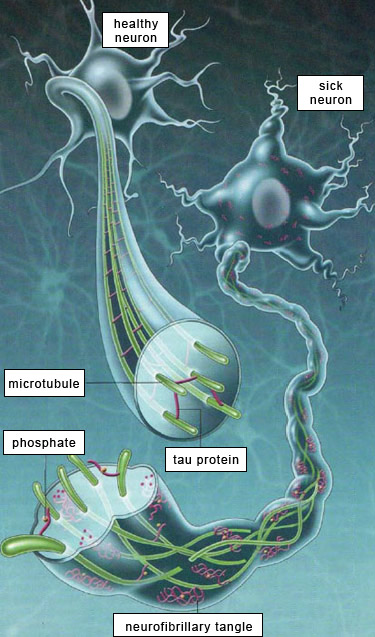
การตรวจสอบเนื้อเยื่อสมองของผู้ป่วยที่เสียชีวิตด้วยโรคอัลไซเมอร์พบว่าเซลล์สมองมีการถูกทำลายจนมวลสมองฝ่อลีบลงมาก ในขณะเดียวกันยังพบการเปลี่ยนแปลงทางกายภาพของสมองที่เด่นชัด 2 ลักษณะ คือ การก่อตัวของแผ่นบีต้า อะมิลอยด์ (beta amyloid plaques) ณ บริเวณนอกเซลล์สมองและการก่อตัวเป็นกระจุกของเส้นใยภายในเซลล์สมอง (neurofibrillary tangles หรือ tau) การก่อตัวของแผ่นบีต้า อะมิลอยด์และเส้นใย tau นี้สามารถก่อความเป็นพิษและค่อยๆทำลายเซลล์สมองโดยเริ่มจากบริเวณกลีบสมองใหญ่ส่วนลึกที่เรียกว่า ฮิปโปแคมปัส (hippocampus) ซึ่งเป็นส่วนของสมองที่เกี่ยวข้องกับความจำก่อนที่จะลุกลามไปยังส่วนอื่นๆของสมอง
การศึกษาวิจัยล่าสุดพบหลักฐานว่าการเกิดอนุมูลอิสระเป็นจำนวนมากจนเกินความสามารถในการกำจัดโดยสารต้านอนุมูลอิสระหรือที่เรียกว่า ภาวะเครียดจากอ็อกซิเดชั่น (oxidative stress) เป็นกระบวนการที่นำไปสู่การตายของเซลล์สมองและการเกิด
โรคอัลไซเมอร์(3-4) และมีความเกี่ยวโยงกับการลดลงของระดับกลูทาไธโอนซึ่งเป็นสารต้านอนุมูลอิสระที่สำคัญของสมอง(5)
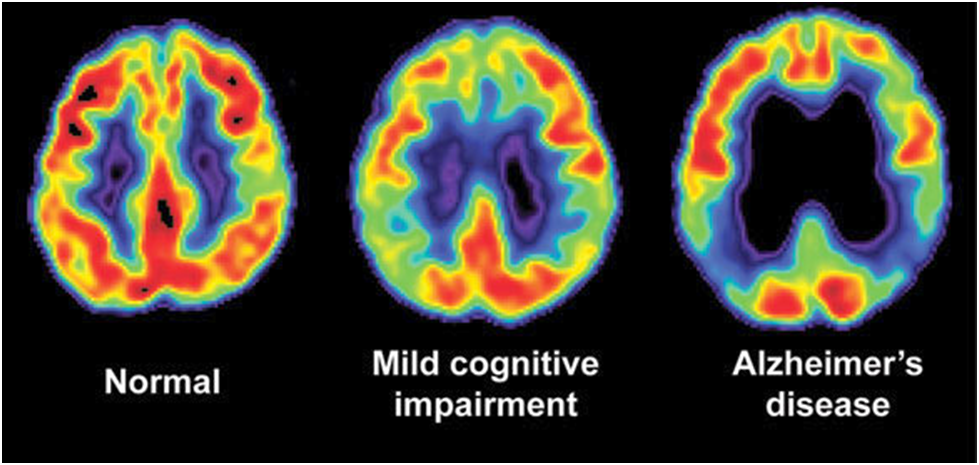
ภาวะเครียดจากอ็อกซิเดชั่นยังสามารถพบได้ตั้งแต่ในระยะก่อนสมองเสื่อม (predementia) ซึ่งเป็นระยะที่ผู้ป่วยมีความบกพร่องทางการเรียนรู้เล็กน้อย (Mild Cognitive Impairment หรือ MCI) และจัดเป็นภาวะเสี่ยงที่สามารถพัฒนาไปเป็นโรคอัลไซเมอร์ได้ในเวลาต่อมา ที่สำคัญหลายรายงานการวิจัยยังพบว่าค่ากลูทาไธโอนที่วัดได้ในพลาสม่าของผู้ป่วยที่มีความบกพร่องทางการเรียนรู้เล็กน้อย (Mild Cognitive Impairment หรือ MCI) และผู้ป่วยอัลไซม์เมอร์มีระดับที่ลดลง โดยระดับการลดลงของกลูทาไธโอนจะยิ่งทวีความรุนแรงสอดคล้องไปกับระดับความรุนแรงของภาวะเครียดจากอ็อกซิเดชั่น(6-9)
หลายการศึกษาวิจัยในห้องทดลองแสดงให้เห็นว่าการขาดกลูทาไธโอนอาจมีส่วนในการเพิ่มความเสี่ยงการเกิดโรคอัลไซเมอร์ได้ โดยหลักฐานเบื้องต้นจากการเพาะเลี้ยงเซลล์ประสาทแสดงให้เห็นว่าแผ่นบีต้า อะมีลอยด์ ขัดขวางระบบรักษาสมดุลของระดับ
กลูทาไธโอนในเซลล์ประสาท (neurons) และเซลล์ค้ำจุนระบบประสาท(astrocytes)และนำไปสู่การขาดกลูทาไธโอนในที่สุด(10-14)
ผลการวิจัยยังแสดงให้เห็นว่าการขาดกลูทาไธโอน นอกจากจะทวีอัตราการสลายตัวของเซลล์ประสาทแล้วยังกระตุ้นส่งเสริมให้เกิดการกระจุกตัวของกลุ่มแผ่นบีต้า อะมีลอยด์อีกด้วย ข้อมูลเหล่านี้สนับสนุนทัศนะที่เชื่อว่าการเปลี่ยนแปลงของระดับกลูทาไธโอนในโรคอัลไซม์เมอร์มิได้เป็นแค่ตัวบ่งชี้ถึงภาวะเครียดจากอ็อกซิเดชั่นเท่านั้น หากแต่ยังอาจเป็นปัจจัยต้นน้ำที่ก่อให้เกิดโรคอัลไซม์เมอร์โดยตรงได้อีกด้วย(15)
ความก้าวหน้าล่าสุดทางเทคโนโลยีสแกนสมองด้วยเครื่องสร้างภาพด้วยสนามแม่เหล็กไฟฟ้า (proton magnetic resonance spectroscopy หรือ MRS) ชนิด MEscher-GArwood PRESS (MEGA-PRESS) ช่วยให้นักวิจัยในปัจจุบันสามารถวัดสัญญาน
ระดับกลูทาไธโอนในสมองส่วนต่าง ๆ ของผู้ป่วยหรือไม่ป่วยได้โดยตรง(16-17) ซึ่งเป็นวิธีที่แม่นยำที่สุดในการบ่งชี้สถานะกลูทาไธโอนในสมองและเป็นประโยชน์อย่างมากต่อการศึกษาความเปลี่ยนแปลงของระดับกลูทาไธโอนในระยะต่าง ๆ ของโรคทางสมอง
โรคอัลไซเมอร์(3-4) และมีความเกี่ยวโยงกับการลดลงของระดับกลูทาไธโอนซึ่งเป็นสารต้านอนุมูลอิสระที่สำคัญของสมอง(5)
ภาวะเครียดจากอ็อกซิเดชั่นยังสามารถพบได้ตั้งแต่ในระยะก่อนสมองเสื่อม (predementia) ซึ่งเป็นระยะที่ผู้ป่วยมีความบกพร่องทางการเรียนรู้เล็กน้อย (Mild Cognitive Impairment หรือ MCI) และจัดเป็นภาวะเสี่ยงที่สามารถพัฒนาไปเป็นโรคอัลไซเมอร์ได้ในเวลาต่อมา ที่สำคัญหลายรายงานการวิจัยยังพบว่าค่ากลูทาไธโอนที่วัดได้ในพลาสม่าของผู้ป่วยที่มีความบกพร่องทางการเรียนรู้เล็กน้อย (Mild Cognitive Impairment หรือ MCI) และผู้ป่วยอัลไซม์เมอร์มีระดับที่ลดลง โดยระดับการลดลงของกลูทาไธโอนจะยิ่งทวีความรุนแรงสอดคล้องไปกับระดับความรุนแรงของภาวะเครียดจากอ็อกซิเดชั่น(6-9)
หลายการศึกษาวิจัยในห้องทดลองแสดงให้เห็นว่าการขาดกลูทาไธโอนอาจมีส่วนในการเพิ่มความเสี่ยงการเกิดโรคอัลไซเมอร์ได้ โดยหลักฐานเบื้องต้นจากการเพาะเลี้ยงเซลล์ประสาทแสดงให้เห็นว่าแผ่นบีต้า อะมีลอยด์ ขัดขวางระบบรักษาสมดุลของระดับ
กลูทาไธโอนในเซลล์ประสาท (neurons) และเซลล์ค้ำจุนระบบประสาท(astrocytes)และนำไปสู่การขาดกลูทาไธโอนในที่สุด(10-14)
ผลการวิจัยยังแสดงให้เห็นว่าการขาดกลูทาไธโอน นอกจากจะทวีอัตราการสลายตัวของเซลล์ประสาทแล้วยังกระตุ้นส่งเสริมให้เกิดการกระจุกตัวของกลุ่มแผ่นบีต้า อะมีลอยด์อีกด้วย ข้อมูลเหล่านี้สนับสนุนทัศนะที่เชื่อว่าการเปลี่ยนแปลงของระดับกลูทาไธโอนในโรคอัลไซม์เมอร์มิได้เป็นแค่ตัวบ่งชี้ถึงภาวะเครียดจากอ็อกซิเดชั่นเท่านั้น หากแต่ยังอาจเป็นปัจจัยต้นน้ำที่ก่อให้เกิดโรคอัลไซม์เมอร์โดยตรงได้อีกด้วย(15)
ความก้าวหน้าล่าสุดทางเทคโนโลยีสแกนสมองด้วยเครื่องสร้างภาพด้วยสนามแม่เหล็กไฟฟ้า (proton magnetic resonance spectroscopy หรือ MRS) ชนิด MEscher-GArwood PRESS (MEGA-PRESS) ช่วยให้นักวิจัยในปัจจุบันสามารถวัดสัญญาน
ระดับกลูทาไธโอนในสมองส่วนต่าง ๆ ของผู้ป่วยหรือไม่ป่วยได้โดยตรง(16-17) ซึ่งเป็นวิธีที่แม่นยำที่สุดในการบ่งชี้สถานะกลูทาไธโอนในสมองและเป็นประโยชน์อย่างมากต่อการศึกษาความเปลี่ยนแปลงของระดับกลูทาไธโอนในระยะต่าง ๆ ของโรคทางสมอง
การศึกษาโดยใช้เครื่องสแกนสมองดังกล่าวพบว่า การลดลงของระดับ
กลูทาไธโอนในสมองของผู้ป่วยอัลไซเมอร์พบได้ในกลีบสมองใหญ่ส่วนลึก(hippocampus) และในสมองใหญ่กลีบด้านหน้า (frontal cortex) ยิ่งไปกว่านั้น กลูทาไธโอนที่ลดต่ำลงในสมองสองบริเวณนี้ยังมีสหสัมพันธ์กับความเสื่อมลงของการใช้ความคิดและเหตุผล ผลการวิเคราะห์คุณลักษณะต่าง ๆ ในสมองแสดงให้เห็นว่าระดับกลูทาไธโอนใน hippocampus สามารถแยกแยะระหว่างภาวะมีความบกพร่องทางการเรียนรู้เล็กน้อย (Mild Cognitive Impairment หรือ MCI) กับภาวะสมองคนปกติได้อย่างชัดเจน ส่วนระดับกลูทาไธโอนที่วัดได้ในสมองใหญ่กลีบด้านหน้า (frontal cortex) มีความจำเพาะหรือความแม่นยำในการวินิจฉัยแยกแยะระหว่างผู่ป่วยโรคอัลไซม์เมอร์กับผู้ป่วยมีความบกพร่องทางการเรียนรู้เล็กน้อยได้แม่นยำสูงถึง 91.7% และมีประสิทธิภาพในการวินิจฉัยผู้ป่วยว่าไม่ได้ป่วยเป็นโรคที่ตนเองไม่ได้เป็นได้ถูกต้องถึง 100%(18)
กลูทาไธโอนในสมองของผู้ป่วยอัลไซเมอร์พบได้ในกลีบสมองใหญ่ส่วนลึก(hippocampus) และในสมองใหญ่กลีบด้านหน้า (frontal cortex) ยิ่งไปกว่านั้น กลูทาไธโอนที่ลดต่ำลงในสมองสองบริเวณนี้ยังมีสหสัมพันธ์กับความเสื่อมลงของการใช้ความคิดและเหตุผล ผลการวิเคราะห์คุณลักษณะต่าง ๆ ในสมองแสดงให้เห็นว่าระดับกลูทาไธโอนใน hippocampus สามารถแยกแยะระหว่างภาวะมีความบกพร่องทางการเรียนรู้เล็กน้อย (Mild Cognitive Impairment หรือ MCI) กับภาวะสมองคนปกติได้อย่างชัดเจน ส่วนระดับกลูทาไธโอนที่วัดได้ในสมองใหญ่กลีบด้านหน้า (frontal cortex) มีความจำเพาะหรือความแม่นยำในการวินิจฉัยแยกแยะระหว่างผู่ป่วยโรคอัลไซม์เมอร์กับผู้ป่วยมีความบกพร่องทางการเรียนรู้เล็กน้อยได้แม่นยำสูงถึง 91.7% และมีประสิทธิภาพในการวินิจฉัยผู้ป่วยว่าไม่ได้ป่วยเป็นโรคที่ตนเองไม่ได้เป็นได้ถูกต้องถึง 100%(18)
มาตรการต่างๆ ที่มีศักยภาพในการรักษาหรือฟื้นฟูระดับกลูทาไธโอนให้ร่างกายและสมองอาจจะเป็นกลยุทธ์ที่สามารถบรรเทาอาการหรือหลีกเลี่ยงการเกิดโรคอัลไซม์เมอร์ได้ กลูทาไธโอนอาจเป็นปัจจัยสำคัญในพยาธิกำเนิดของโรคอัลไซม์เมอร์และการวัดค่ากลูทาไธโอนอาจเป็นแนวทางใหม่ที่ช่วยในการวินิจฉัยโรครวมไปถึงการบำบัดโรคที่มีลักษณะจำเพาะเจาะจง(targeted therapy)
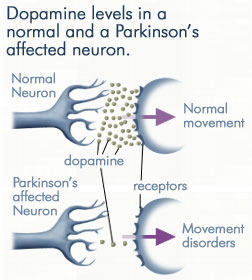
โรคพาร์กินสัน
หลักฐานจากการศึกษาวิจัยที่เพิ่มมากขึ้นเรื่อยๆแสดงให้เห็นว่า ความเสียหายที่เกิดกับไมโทคอนเดรีย (mitochondria) ซึ่งเป็นองค์ประกอบภายในเซลล์ที่ทำหน้าที่ผลิตพลังงานให้แก่เซลล์อาจเป็นสาเหตุสำคัญในการเกิดโรคพาร์กินสัน อัลไซเมอร์และโรคความเสื่อมทางสมองอื่น ๆ(19-23)โดยความเสื่อมของไมโทคอนเดรียนี้จะก่อให้เกิดการผลิตอนุมูลอิสระในอัตราสูงขึ้นอย่างมาก ตามด้วยการเสียสมดุลของปริมาณสารต้านอนุมูลอิสระในร่างกายและการบกพร่องของระดับกลูทาไธโอน(24-27) ภาวะเครียดจากอ็อกซิเดชั่น (oxidative stress) ที่เกิดขึ้นนี้จะก่อให้เกิดความเสียหายกับชีวโมเลกุลและองค์ประกอบต่าง ๆ ของเซลล์และสามารถนำไปสู่การสลายตัวของเซลล์ (apoptosis) ได้ในที่สุด
การศึกษาโดย Sian J. และคณะพบว่า ระดับกลูทาไธโอนในสมองส่วนซับสแตนเชีย
ไนกร้า (substantia nigra) ของผู้ป่วยโรคพาร์กินสันระยะแรกมีปริมาณลดลงถึง 40% เมื่อเทียบกับระดับที่พบได้ในคนปกติ(24) และยังลดลงต่ออย่างมากในระยะหลังๆของโรค โดยอัตราการลดลงของระดับกลูทาไธโอนนี้มีความสัมพันธ์กับระดับความรุนแรงของโรค(27) ดังนั้นระดับกลูทาไธโอนที่ต่ำกว่าปกติและการเสียสมดุลของปริมาณสารต้านอนุมูลอิสระใน
ผู้ป่วยโรคพาร์กินสันจึงถือเป็นปัจจัยสำคัญที่สามารถนำไปสู่การสูญเสียเซลล์สมองที่ทำหน้าที่ผลิตโดพามีน (dopamine) ซึ่งเป็นสารสื่อประสาทในสมองส่วน ซับสแตนเชีย ไนกร้า ที่ใช้ในการสื่อสารสั่งงานด้านความเคลื่อนไหว(25-26)
ด้วยเหตุนี้เองนักวิทยาศาสตร์หลายคณะจึงได้ทำการศึกษาคุณประโยชน์ของการใช้สารต้านอนุมูลอิสระโดยเฉพาะคุณประโยชน์
ของกลูทาไธโอนในการชะลอการเสื่อมของเซลล์สมอง(24-27) การศึกษาวิจัยโดย Gabby M. และคณะที่นำเซลล์ประสาทของมนุษย์มาเพาะเลี้ยงพบว่า กลูทาไธโอนสามารถปกป้องเซลล์ประสาทจากการสลายตัวเองหลังจากถูกกระตุ้นโดยสารโดพามีนได้(26)

ส่วนทีมวิจัยของ Sechi และคณะได้ทำการพิสูจน์ให้เห็นว่าการฉีดสารสังเคราะห์กลูทาไธโอนเข้าทางเส้นเลือดมีประสิทธิภาพในการลดอาการของผู้ป่วยโรคพาร์กินสันระยะแรกได้ถึง 42% และมีผลในการชะลอพัฒนาการของโรคได้(27) Banaclocha ได้ทำการศึกษาคุณประโยชน์ของสารตัวยา N-acetyl cysteine (NAC) ซึ่งเป็นสารตั้งต้นในการสังเคราะห์กลูทาไธโอนที่ได้ถูกนำไปใช้ในการวิจัยทางวิทยาศาสตร์ต่างๆ พบว่าสารตัวยานี้สามารถมอบผลในการปกป้องเซลล์สมองโดยช่วยบรรเทาหรือชะลออาการโรคพาร์กินสันและโรคอัลไซเมอร์รวมถึงโรคความเสื่อมทางสมองอื่นๆที่เกิดจากความชราได้(19) แต่มาตราการในการเพิ่มระดับกลูทาไธโอนในสมองแบบต่อเนื่องระยะยาวนั้น ควรพิจารณาทางเลือกอื่นๆที่ปราศจากผลข้างเคียงที่อาจเกิดขึ้นได้จากการใช้ยา ทั้งนี้การเสริมอาหารด้วย HMS 90® เวย์โปรตีนไอโซเลตที่อุดมด้วยกรดอะมิโนซีสเตอีนที่คงคุณค่าทางชีวภาพน่าจะเป็นวิธีที่ดีกว่าเนื่องจากเป็นสารสกัดโปรตีนนมธรรมชาติที่ปลอดภัยและได้รับการพิสูจน์โดยการศึกษาวิจัยทางคลีนิกที่ได้รับการตีพิมพ์ในวารสารการแพทย์นานาชาติแล้วว่าสามารถเพิ่ม
ระดับกลูทาไธโอนในเซลล์ของผู้ใช้ได้อย่างมีประสิทธิภาพโดยไม่ก่อให้เกิดผลข้างเคียงใด ๆ(28-29)
ระดับกลูทาไธโอนในเซลล์ของผู้ใช้ได้อย่างมีประสิทธิภาพโดยไม่ก่อให้เกิดผลข้างเคียงใด ๆ(28-29)
เอกสารอ้างอิง
1. Dringen R. Metabolism and functions of glutathione in brain. Prog Neurobiol 62, 649-671, 2000
2. Schulz JB et al. Glutathione, oxidative stress and neurodegeneration. Eur J Biochem 267, 4904-4911, 2000
3. Nunomura A, Castellani RJ, Zhu X et al. Involvement of oxidative stress in Alzheimer disease. J Neuropathol
Exp Neurol 65, 631-641, 2006
4. Bonda DJ, Wang X, Perry G et al. Oxidative stress in Alzheimer disease: A possibility for prevention.
Neuropharmacology 59, 290-294, 2010
5. Saharana S, Mandala PK. The Emerging Role of Glutathione in Alzheimer’s Disease. Journal of Alzheimer’s
Disease 40: 519–529, 2014
6. Bermejo P, Martin-Aragon S, Benedi J ,et al. Peripheral levels of glutathione and protein oxidation as markers
in the development of Alzheimer’s disease from Mild Cognitive Impairment. Free Radic Res 42: 162-170, 2008
7. Puertas MC, Martinez-Martos JM, Cobo MP, et al. Plasma oxidative stress parameters in men and women with
early stage Alzheimer type dementia. Exp Gerontol 47: 25-630, 2012
8. Cristalli DO, Arnal N, Marra FA et al. Peripheral markers in neurodegenerative patients and their first-degree
relatives. J Neurol Sci 314: 48-56, 2011
9. Liu H, Harrell LE, Shenvi S, Hagen T, Liu RM. Gender differences in glutathione metabolism in Alzheimer’s
disease. J Neurosci Res 79: 861-867, 2005
10. White AR, Bush AI, Beyreuther K, et al. Exacerbation of copper toxicity in primary neuronal cultures
depleted of cellular glutathione. J Neurochem 72: 2092-2098, 1999
11. Cardoso SM, Oliveira CR Glutathione cycle impairment mediates A beta-induced cell toxicity. Free Radic Res
37: 241-250, 2003
12. Akterin S, Cowburn RF, Miranda-Vizuete A, et al. Involvement of glutaredoxin-1 and thioredoxin-1 in
betaamyloid toxicity and Alzheimer’s disease. Cell Death Differ 13: 1454-1465, 2006
13. Abramov AY, Canevari L, Duchen MR. Changes in intracellular calcium and glutathione in astrocytes as the
primary mechanism of amyloid neurotoxicity. J Neurosci 2: 5088-5095, 2003
14. Casley CS, Land JM, Sharpe MA, et al. Beta-amyloid fragment 25-35 causes mitochondrial dysfunction in
primary cortical neurons. Neurobiol Dis 10: 258-267, 2002
15. Woltjer RL, Nghiem W, Maezawa I, et al. Role of glutathione in intracellular amyloid-alpha precursor
protein/carboxy-terminal fragment aggregation and associated cytotoxicity. J Neurochem 93: 1047-1056, 2005
16. Mandal PK, Tripathi M, Sugunan S. Brain oxidative stress: Detection and mapping of anti-oxidant marker
‘Glutathione’ in different brain regions of healthy male/female, MCI and Alzheimer patients using non-
invasive magnetic resonance spectroscopy. Biochem Biophys Res Commun 417: 43-48, 2012
17. Duffy SL, Lagopoulos J, Hickie IB, et al. Glutathione relates to neuropsychological functioning in mild
cognitive impairment. Alzheimers Dement 10: 67-75, 2014
18. Mandal PK, Saharan S, Tripathi M, Murari G. Brain glutathione levels--a novel biomarker for mild cognitive
impairment and Alzheimer's disease. Biol Psychiatry 15; 78(10):702-10, 2015
19. Banaclocha MM. Therapeutic potential of N-acetylcysteine in age-related mitochondrial neurodegenerative
diseases. Med Hypotheses 56:472-477, 2001
20. Schultz JB, Lindenau J, Seyfried J et al. Glutathione, oxidative stress and neurodegeneration. Eur J Biochem
267:4904-4911,2000
21. Jenner P, Olanow CW. Oxidative stress and the pathogenesis of Parkinson's disease. Neurology 47:S1161-
S170,1996
22. Kidd PM. Parkinson’s disease as a multifactorial oxidative neurodegeneration: implications for integrative
management. Altern Med Rev 5:501,2000
23. Lohr JB, Browning JA. Free radical involvement in neuropsychiatric illnesses. Psychopharmacol Bull 31:159-
165,1995
24. Reid M, Jahoor F. Glutathione in disease. Curr Opin Clin Nutr Metab Care 4:65-71,2001
25. Sian J, Dexter DT, Lees AJ et al. Alterations in glutathione levels in Parkinson’s disease and other
neurodegenerative disorders affecting basal ganglia. Ann Neurol 348-355,1994
26. Gabby M, Tauber M, Porat S et al. Selective role of glutathione in protecting human neuronal cells from
dopamine-induced apoptosis. Neuropharmacology 35:571-578,1996
27. Sechi G, Deledda MG, Bua G et al. Reduced intravenous glutathione in the treatment of early Parkinson’s
disease. Prog Neuropsychopharmacol Biol Psychiatry 20: 1159-1170,1996
28. Lands L, Grey VL, Smountas AA. Effect of supplementation with a cysteine donor on muscular performance.
J Appl Physiol 87:1381-1385,1999
29. Tosukhowong P, Bhidayasiri R et al. Biochemical and clinical effects ofWhey protein supplementation in
Parkinson's disease: A pilot study. Journal of the Neurological Sciences 367:162–170, 2016
HMS 90®
Contact Details
บริษัท อิมมูโนไทย จำกัด245/4 ถ.สุขุมวิท 21 (อโศก) แขวงคลองเตยเหนือ เขตวัฒนา กรุงเทพฯ 10110092-696-6925info@immunothai.co.th

